Não se desesperem nós iremos ajudar você!

Aqui você encontrará uma série de atividades práticas que você pode fazer relacionadas ao assunto que você encontra aqui no quimicalogia. Espero que gostem :D

Aqui você encontrará uma série de atividades práticas que você pode fazer relacionadas ao assunto que você encontra aqui no quimicalogia. Espero que gostem :D
ATIVIDADE PRÁTICA DE TERMOQUÍMICA
Aqui você encontrará atividades práticas que você pode fazer que são relacionadas com a termoquímica.bem simples que você pode fazer em casa.
1 ATIVIDADE PRÁTICA:
1°Procedimento
• Esfregue as mãos uma na outra. •Observe o que acontece e anote no caderno.
• Esfregue as mãos uma na outra. •Observe o que acontece e anote no caderno.
Pergunta
1) O que ocorreu? Por quê?
1) O que ocorreu? Por quê?
ATENÇÃO: Nunca cheire nem experimente substância alguma utilizada nestas atividades. Os experimentos 2 e 3 devem ser realizados com a supervisão de um adulto, pois o etanol (álcool comum)
não deve ser manipulado perto de chamas ou faíscas. Ele pode se inflamar e causar queimaduras, incêndios e explosões.
2 ATIVIDAE PRÁTICA:
#Materiais
• água • álcool • toalha
Procedimento:
• Molhe as mãos com água. •

Enxugue-as e, em seguida, molhe-as com álcool. • Observe se há diferença nas sensações e anote no caderno.
Pergunta:• água • álcool • toalha
Procedimento:
• Molhe as mãos com água. •

Enxugue-as e, em seguida, molhe-as com álcool. • Observe se há diferença nas sensações e anote no caderno.
1) Em qual das duas situações você sentiu maior sensação de frio? Tente explicar.
3 ATIVIDADE PRÁTICA:
#Materiais
• álcool • 1 termômetro

• 1 pedaço de barbante
• 1 chumaço de algodão
Procedimento:
• Pendure o termômetro com o barbante e anote a temperatura no caderno.• Envolva o bulbo do termômetro com o algodão, molhe o algodão com álcool e, após alguns minutos, leia novamente a temperatura, anotando no caderno.
Pergunta:
1) O que aconteceu? Por quê?
4 ATIVIDADE PRÁTICA:
#Pesquisa

Procure obter, consultando livros, rótulos de alimentos industrializados, etc., as “calorias” de vários alimentos. Compare o “conteúdo energético” de grupos de alimentos como: frutas, legumes, massas, etc.
ATIVIDADE PRÁTICA DE ELETROQUÍMICA

ATENÇÃO: Este experimento deve ser realizado com a supervisão de um adulto. O material marcado com asterisco (*) deve ser preparado em solução adequadamente diluída. Nunca cheire nem experimente substância alguma utilizada nestas atividades.
1° Atividade

Materiais
• CuSO4 (aq) 0,2 mol/L* • 1 lâmina de zinco • 1 béquer de 250 mL
Procedimento:
• Mergulhe a lâmina de zinco na solução de sulfato de cobre II. • Anote as observações no caderno.
Perguntas:
1) Que tipo de reação ocorreu?
2) Escreva a equação química que representa o processo.
3) Quem é o agente oxidante e quem é o agente redutor?
4) Escreva as semi-reações que ocorrem no processo.
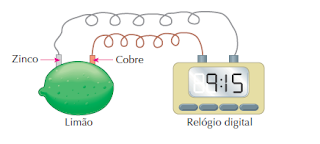
2° Atividade:

Materiais:
• 1 limão• 1 lâmina de cobre conectada a um fio encapado
• 1 lâmina de zinco conectada a um fio encapado • 1 relógio digital
Procedimento:
• Limpe cuidadosamente as duas lâminas e introduza a metade de cada uma delas em um limão, de tal modo que as lâminas não se toquem. • Conecte as extremidades dos fios ligados às lâminas em um relógio digital, conforme o esquema:
Perguntas
1) O que ocorreu?
2) O limão poderia ser substituído por laranja? Por quê?
3° Atividade

Pesquisa:
Os objetos de prata escurecem com o passar do tempo. Isso ocorre porque compostos de enxofre, existentes como impurezas no ar, atacam a prata, formando uma película de Ag2S (preta) na superfície do objeto. Uma maneira de limpar a prata, fazendo-a voltar à cor primitiva, é envolver o objeto em papel-alumínio e colocar o conjunto numa panela também de alumínio, tudo recoberto com uma solução diluída de bicarbonato de sódio. Após alguns dias, o objeto estará limpo. Como explicar o ocorrido?
4°Atividade

Materiais:
• 1 papel de filtro• 1 lâmina de microscópio• 2 conectores tipo “jacaré” • 1 bateria de 9 V • 1 lápis para marcar o papel •1 régua• 1 tesoura• 1 caneta para transparência• cristais de permanganato de KMnO4 (s) • 1 espátula • água
Procedimento:
• Faça uma marca de + (positivo) e outra de – (negativo), com a caneta para transparência, nas extremidades da lâmina para mostrar a qual terminal de fonte cada ponta está conectada. • Corte um pedaço de papel de filtro ligeiramente menor que uma lâmina de microscópio.• Desenhe levemente uma linha no centro.• Umedeça o papel de filtro com água e fixe o papel umedecido na lâmina com os “jacarés”. • Coloque, com uma espátula, um pequeno cristal de permanganato de potássio no centro do
papel. • Conecte os “jacarés” a uma fonte de energia não superior a 9 V e aguarde cerca de 10 minutos. • Anote as observações no caderno.
Perguntas:
1) Estabelecendo-se que o fio vermelho representa o pólo positivo e o fio preto, o pólo negativo da bateria, e que o permanganato de potássio consiste em dois íons, íon potássio e íon permanganato, para qual pólo migra o íon potássio e para qual pólo migra o íon permanganato?
2) Observando a direção e o sentido do movimento anotados no caderno, qual é a carga do íon permanganato?
Fontes: Feltre, Ricardo, 1928-.Química / Ricardo Feltre. — 6. ed. —São Paulo : Moderna, 2004.


Nenhum comentário:
Postar um comentário