Iremos ensinar sobre a entalpia padrão de formação. O assunto não complicado mas é bom ter atenção...
Teoricamente, o cálculo do valor do só seria em princípio possível se fossem conhecidas as entalpias absolutas dos reagentes (
só seria em princípio possível se fossem conhecidas as entalpias absolutas dos reagentes ( ) e dos produtos (
) e dos produtos (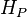 ) visto que
) visto que 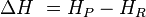 .
.
Tais valores absolutos, entretanto, são praticamente impossíveis de serem diretamente mensurados experimentalmente dado a utopia prática de um sistema de referência em um estado de entalpia absoluta zero. Na prática tem-se em verdade não há ganho ou obrigatoriedade alguma de que as entalpias a serem consideradas no cálculo sejam as entalpias absolutas dos estados do sistema. Tal consideração decorre do fato que, experimentalmente, com o uso do calorímetro, só é possível obterem-se os valores das variações devido às transformações do sistema visto que o calorímetro permite
mensurar apenas o calor perdido ou recebido pelo sistema durante uma
dada transformação, mas não a energia interna e a energia associada ao
volume sob pressão de um estado particular do sistema. As variações de
entalpia correspondem pois às grandezas experimentalmente mesuráveis e
de relevância.
devido às transformações do sistema visto que o calorímetro permite
mensurar apenas o calor perdido ou recebido pelo sistema durante uma
dada transformação, mas não a energia interna e a energia associada ao
volume sob pressão de um estado particular do sistema. As variações de
entalpia correspondem pois às grandezas experimentalmente mesuráveis e
de relevância.
Cansou? Não desista Chegaremos lá!
Em vista da situação há pois uma liberdade de escolha quanto ao "nível" de referência ao qual associar-se-á por definição um valor de entalpia nulo visto que não há razão prática alguma que acarrete a necessidade da entalpia "zero" encontrar-se obrigatoriamente associada - como encontra-se na definição de entalpia absoluta - a um estado do sistema à temperatura de zero kelvins e cujos volume e energia interna clássicos sejam nulos - ou seja, ao estado naturalmente determinado para o qual a entalpia absoluta é nula. De forma similar ao que ocorre com a determinação de diferenças de alturas, onde o valor obtido para a espessura ("altura") de uma mesa - ou seja, a diferenças de alturas entre o topo e o pé da mesa - independe do nível de referência escolhido para medirem-se as alturas a serem subtraídas - podendo estas serem medidas tanto em relação o piso da sala como em relação o nível do mar sem contudo afetar-se o resultado de interesse prático - pode-se em princípio também escolher um nível de referência qualquer a partir do qual as entalpias serão mensuradas e a partir dos quais as variações de entalpia sejam sempre corretamente determináveis.
Embora a escolha do "nível" de referência seja em princípio livre, é extremamente valioso que este estabeleça-se um padrão experimentalmente bem definido e que seja por todos facilmente reprodutível e universalmente reconhecido, de forma a permitir a fácil determinação dos valores de entalpia para as mais variadas substâncias puras compostas visto que isso certamente facilitará muito o cálculo teórico do nas milhares de transformações químicas existentes bem como o
intercâmbio de dados e resultados práticos entre profissionais dos mais
diversificados ramos de atividade pertinentes. A fim de estabelecer tal
nível de referência padrão determinaram-se primeiramente, entre outros,
as condições físico-químicas de referência para os quais a entalpia -
esta doravante nomeada entalpia-padrão
nas milhares de transformações químicas existentes bem como o
intercâmbio de dados e resultados práticos entre profissionais dos mais
diversificados ramos de atividade pertinentes. A fim de estabelecer tal
nível de referência padrão determinaram-se primeiramente, entre outros,
as condições físico-químicas de referência para os quais a entalpia -
esta doravante nomeada entalpia-padrão 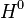 - será definida como zero. Convencionou-se, entre outros, que constituir-se-á o sistema de referência por todas as substâncias simples, e que o estado padrão será o estado físico e alotrópico mais estável destas substâncias à temperatura de 25°C e pressão de 1 atm..
A partir desta definição, mensurada a variação de entalpia em qualquer
processo que leve o sistema das condições de referência - a justaposição
para reação da mistura de substâncias simples - a um estado final em
particular - a substância composta formada - foi e é possível
determinar-se a entalpia-padrão associada a qualquer estado final
desejado, e de forma recorrente, as entalpias-padrão e variações de
entalpia para as mais diversas reações, mesmo para aquelas envolvendo
várias substâncias puras ou mesmo compostas atuando tanto como reagentes
quanto como produtos. Tais entalpias-padrão, ou suas variações - cujos
valores coincidem com as variações de entalpia absoluta - encontram-se
desta forma tabeladas em muitos livros de química e física para as mais
diversas substâncias e reações químicas.
- será definida como zero. Convencionou-se, entre outros, que constituir-se-á o sistema de referência por todas as substâncias simples, e que o estado padrão será o estado físico e alotrópico mais estável destas substâncias à temperatura de 25°C e pressão de 1 atm..
A partir desta definição, mensurada a variação de entalpia em qualquer
processo que leve o sistema das condições de referência - a justaposição
para reação da mistura de substâncias simples - a um estado final em
particular - a substância composta formada - foi e é possível
determinar-se a entalpia-padrão associada a qualquer estado final
desejado, e de forma recorrente, as entalpias-padrão e variações de
entalpia para as mais diversas reações, mesmo para aquelas envolvendo
várias substâncias puras ou mesmo compostas atuando tanto como reagentes
quanto como produtos. Tais entalpias-padrão, ou suas variações - cujos
valores coincidem com as variações de entalpia absoluta - encontram-se
desta forma tabeladas em muitos livros de química e física para as mais
diversas substâncias e reações químicas.
Tem-se pois que pela definição as entalpias-padrão do hidrogênio ( ), do oxigênio (
), do oxigênio ( )
ou do grafite (C) quando nas condições padrão, ou seja, a 25°C de
temperatura e 1 atm. de pressão, são por definição, zero. O mesmo já não
ocorre para o diamente (carbono em estado alotrópico menos estável),
)
ou do grafite (C) quando nas condições padrão, ou seja, a 25°C de
temperatura e 1 atm. de pressão, são por definição, zero. O mesmo já não
ocorre para o diamente (carbono em estado alotrópico menos estável),  (substância composta) e outras, mesmo que nas condições padrão de temperatura e pressão.
(substância composta) e outras, mesmo que nas condições padrão de temperatura e pressão.
É conveniente explicitar-se que, conforme definidas, a entalpia absoluta e a entalpia-padrão diferem entre si por uma mera subtração de um valor adequadamente escolhido para cada situação:
 onde C representa uma constante.
onde C representa uma constante.
Uma vez estabelecido o padrão de referência e uma forma de mensurarem-se as entalpias-padrão dos sistemas nos seus diversos estados, mostra-se também válido estabelecer alguns conceitos de utilidade prática derivados, a exmplo os conceitos de entalpias de formação e de entalpia de combustão das substâncias.
Se você teve preguiça de ler mas tem que aprender o assunto preste atenção no vídeo abaixo:
Teoricamente, o cálculo do valor do
 só seria em princípio possível se fossem conhecidas as entalpias absolutas dos reagentes (
só seria em princípio possível se fossem conhecidas as entalpias absolutas dos reagentes ( ) e dos produtos (
) e dos produtos (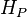 ) visto que
) visto que 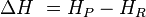 .
.Tais valores absolutos, entretanto, são praticamente impossíveis de serem diretamente mensurados experimentalmente dado a utopia prática de um sistema de referência em um estado de entalpia absoluta zero. Na prática tem-se em verdade não há ganho ou obrigatoriedade alguma de que as entalpias a serem consideradas no cálculo sejam as entalpias absolutas dos estados do sistema. Tal consideração decorre do fato que, experimentalmente, com o uso do calorímetro, só é possível obterem-se os valores das variações
 devido às transformações do sistema visto que o calorímetro permite
mensurar apenas o calor perdido ou recebido pelo sistema durante uma
dada transformação, mas não a energia interna e a energia associada ao
volume sob pressão de um estado particular do sistema. As variações de
entalpia correspondem pois às grandezas experimentalmente mesuráveis e
de relevância.
devido às transformações do sistema visto que o calorímetro permite
mensurar apenas o calor perdido ou recebido pelo sistema durante uma
dada transformação, mas não a energia interna e a energia associada ao
volume sob pressão de um estado particular do sistema. As variações de
entalpia correspondem pois às grandezas experimentalmente mesuráveis e
de relevância.Cansou? Não desista Chegaremos lá!
Em vista da situação há pois uma liberdade de escolha quanto ao "nível" de referência ao qual associar-se-á por definição um valor de entalpia nulo visto que não há razão prática alguma que acarrete a necessidade da entalpia "zero" encontrar-se obrigatoriamente associada - como encontra-se na definição de entalpia absoluta - a um estado do sistema à temperatura de zero kelvins e cujos volume e energia interna clássicos sejam nulos - ou seja, ao estado naturalmente determinado para o qual a entalpia absoluta é nula. De forma similar ao que ocorre com a determinação de diferenças de alturas, onde o valor obtido para a espessura ("altura") de uma mesa - ou seja, a diferenças de alturas entre o topo e o pé da mesa - independe do nível de referência escolhido para medirem-se as alturas a serem subtraídas - podendo estas serem medidas tanto em relação o piso da sala como em relação o nível do mar sem contudo afetar-se o resultado de interesse prático - pode-se em princípio também escolher um nível de referência qualquer a partir do qual as entalpias serão mensuradas e a partir dos quais as variações de entalpia sejam sempre corretamente determináveis.
Embora a escolha do "nível" de referência seja em princípio livre, é extremamente valioso que este estabeleça-se um padrão experimentalmente bem definido e que seja por todos facilmente reprodutível e universalmente reconhecido, de forma a permitir a fácil determinação dos valores de entalpia para as mais variadas substâncias puras compostas visto que isso certamente facilitará muito o cálculo teórico do
 nas milhares de transformações químicas existentes bem como o
intercâmbio de dados e resultados práticos entre profissionais dos mais
diversificados ramos de atividade pertinentes. A fim de estabelecer tal
nível de referência padrão determinaram-se primeiramente, entre outros,
as condições físico-químicas de referência para os quais a entalpia -
esta doravante nomeada entalpia-padrão
nas milhares de transformações químicas existentes bem como o
intercâmbio de dados e resultados práticos entre profissionais dos mais
diversificados ramos de atividade pertinentes. A fim de estabelecer tal
nível de referência padrão determinaram-se primeiramente, entre outros,
as condições físico-químicas de referência para os quais a entalpia -
esta doravante nomeada entalpia-padrão 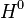 - será definida como zero. Convencionou-se, entre outros, que constituir-se-á o sistema de referência por todas as substâncias simples, e que o estado padrão será o estado físico e alotrópico mais estável destas substâncias à temperatura de 25°C e pressão de 1 atm..
A partir desta definição, mensurada a variação de entalpia em qualquer
processo que leve o sistema das condições de referência - a justaposição
para reação da mistura de substâncias simples - a um estado final em
particular - a substância composta formada - foi e é possível
determinar-se a entalpia-padrão associada a qualquer estado final
desejado, e de forma recorrente, as entalpias-padrão e variações de
entalpia para as mais diversas reações, mesmo para aquelas envolvendo
várias substâncias puras ou mesmo compostas atuando tanto como reagentes
quanto como produtos. Tais entalpias-padrão, ou suas variações - cujos
valores coincidem com as variações de entalpia absoluta - encontram-se
desta forma tabeladas em muitos livros de química e física para as mais
diversas substâncias e reações químicas.
- será definida como zero. Convencionou-se, entre outros, que constituir-se-á o sistema de referência por todas as substâncias simples, e que o estado padrão será o estado físico e alotrópico mais estável destas substâncias à temperatura de 25°C e pressão de 1 atm..
A partir desta definição, mensurada a variação de entalpia em qualquer
processo que leve o sistema das condições de referência - a justaposição
para reação da mistura de substâncias simples - a um estado final em
particular - a substância composta formada - foi e é possível
determinar-se a entalpia-padrão associada a qualquer estado final
desejado, e de forma recorrente, as entalpias-padrão e variações de
entalpia para as mais diversas reações, mesmo para aquelas envolvendo
várias substâncias puras ou mesmo compostas atuando tanto como reagentes
quanto como produtos. Tais entalpias-padrão, ou suas variações - cujos
valores coincidem com as variações de entalpia absoluta - encontram-se
desta forma tabeladas em muitos livros de química e física para as mais
diversas substâncias e reações químicas.Tem-se pois que pela definição as entalpias-padrão do hidrogênio (
 ), do oxigênio (
), do oxigênio ( )
ou do grafite (C) quando nas condições padrão, ou seja, a 25°C de
temperatura e 1 atm. de pressão, são por definição, zero. O mesmo já não
ocorre para o diamente (carbono em estado alotrópico menos estável),
)
ou do grafite (C) quando nas condições padrão, ou seja, a 25°C de
temperatura e 1 atm. de pressão, são por definição, zero. O mesmo já não
ocorre para o diamente (carbono em estado alotrópico menos estável),  (substância composta) e outras, mesmo que nas condições padrão de temperatura e pressão.
(substância composta) e outras, mesmo que nas condições padrão de temperatura e pressão.É conveniente explicitar-se que, conforme definidas, a entalpia absoluta e a entalpia-padrão diferem entre si por uma mera subtração de um valor adequadamente escolhido para cada situação:
 onde C representa uma constante.
onde C representa uma constante.Uma vez estabelecido o padrão de referência e uma forma de mensurarem-se as entalpias-padrão dos sistemas nos seus diversos estados, mostra-se também válido estabelecer alguns conceitos de utilidade prática derivados, a exmplo os conceitos de entalpias de formação e de entalpia de combustão das substâncias.
Se você teve preguiça de ler mas tem que aprender o assunto preste atenção no vídeo abaixo:
Fonte: pt.wikipedia.org/wiki/Entalpia_padrão_de_formação



Nenhum comentário:
Postar um comentário