Aqui você encontrará exercícios relacionados aos assuntos postados aqui no quimicalogia, espero que ajude vocês, divirtam se !

Exercícios sobre eletroquímica
01. (PUC) Na pilha eletro-química sempre ocorre:
a) oxidação do cátodo.
b) movimento de elétrons no interior da solução eletrolítica.
c) reação com diminuição de calor.
d) passagem de elétrons, no circuito externo, do ânodo para o cátodo.
e) reação de neutralização.
02. (MACK) Em uma pilha com eletrodos de zinco e de cobre, com circuito fechado, ocorre:
a) o potencial do eletrodo de zinco diminui e o do cobre aumenta;
b) o potencial do dois eletrodos diminui;
c) o potencial do eletrodo de zinco aumenta e o do cobre diminui;
d) o potencial dos dois eletrodos aumenta;
e) o potencial dos dois eletrodos não se altera.
03. (USP) Considere as seguintes semi-reações e os respectivos potenciais normais de redução (E0):
Ni+3 + 2e- ¾¾® Ni0 E0 = -0,25 V
Au+3 + 3e- ¾¾®Au0 E0 = 1,50 V
O potencial da pilha formada pela junção dessas duas semi-reações será:
a) +1,25 V
b) –1,25 V
c) +1,75 V
d) –1,75 V
e) +3,75 V
04. (MACK) A reação que ocorre em uma pilha é representada pela seguinte equação: Mn + Cu++ ® Mn++ + Cu Sabendo-se que o potencial de óxido-redução do manganês é igual a +1,05 volts e o do cobre é igual a –0,35 volts, e admitindo-se que a concentração dos íons é unitária, a voltagem da pilha será:
a) 0,70 volts
b) –1,40 volts
c) 1,40 volts
d) –0,70 volts
e) n.d.a.
05. (SANTA CASA) Dentre as espécies químicas representadas abaixo através de semi-reações:
| Semi-reações | Potencial padrão de Redução (volt) |
| Na+ + e- ® Na | - 2,7 |
| Cu + + e- ® Cu | +0,5 |
| ½ Cl2 + e- ® Cl- | +1,4 |
Qual, nas condições padrão, é a mais oxidante?
a) Na
b) Cu
c) Na+
d) Cu+
e) Cl2
06. (FUVEST) Considere os potenciais padrões de redução:
semi-reação (em solução aquosa) potencial (volt)
Ce4+ + 1e- ® Ce3+ +1,61
Sn4+ + 2e- ® Sn2+ +0,15
Qual das reações deve ocorrer espontaneamente?
a) Ce4+ + Sn4+ ® Ce3+ + Sn2+
b) 2Ce4+ + Sn2+ ® 2Ce3+ + Sn4+
c) Sn4+ + Ce3+ ® Ce4+ + Sn2+
d) Ce3+ + Sn2+ ® Ce4+ + Sn4+
07. (FUVEST) Na reação espontânea do exercício anterior, o oxidante e o redutor são, respectivamente:
a) Ce4+ e Sn+2
b) Ce4+ e Sn4+
c) Ce3+ e Sn2+
d) Sn2+ e Ce4+
e) n.d.a.
08. (PUC) Conhecendo-se as seguintes equações de meia-célula e os respectivos potenciais padrão do eletrodo (E0):
Sn++ + 2e- ® Sn0 E0 = -0,14 volts
Ag+ + e- ® Ag0 E0 = +0,80 volts
Podemos concluir que a pilha eletroquímica que funciona segundo a reação: Sn0 + 2 Ag+ ® Sn++ + 2 Ag0 Apresentará, nas condições padrões, a seguinte diferença de potencial:
a) 0,54 volts
b) 0,66 volts
c) 0,94 volts
d) 1,46 volts
e) 1,74 volts
09. (MACK) Uma cela eletroquímica é constituída pelas semicelas Cr // Cr+3 e Ag // Ag+ cujos valores potenciais E0 são:
Cr(s) ® Cr+3(aq) + 3e- E0 = +0,75 volts
Ag (s) ® Ag+(aq) + e- E0 = -0,80 volts
Quando a cela está em funcionamento, á FALSA a afirmação de que:
a) O eletrodo, onde ocorre oxidação é o ânodo da cela.
b) A voltagem da cela é de 1,55 volts.
c) O cromo metálico reage e forma Cr+3.
d) Os íons negativos e positivos se movimentam através da solução, mas em direções opostas.
e) Os elétrons passam através do voltímetro, da prata para o cromo.
Resolução:
| 01. D | 02. A | 03. C | 04. C |
| 05. E | 06. B | 07. A | 08. C |
| 09. E |
FONTE: http://www.coladaweb.com/exercicios-resolvidos/exercicios-resolvidos-de-quimica/eletroquimica
Exercícios sobre termoquímica

01. (OSEC) Analise as afirmativas abaixo:
I. Entalpia (H) pode ser conceituada como a energia global de um sistema.
II. Uma reação exotérmica apresenta D H positivo.
III. O calor de reação de um processo químico será dado por D H.
a) somente I é correta
b) somente II é correta
c) somente III é correta
d) as afirmativas I e II são corretas
e) as afirmativas I e III são corretas.
02. Pode uma transformação apresentar diminuição de entalpia e diminuição de entropia ser espontânea?
03. (OSEC) Considerando-se a transformação isotérmica N2O(g) ® N2(g) + O2(g) à 25°C e sabendo-se que a variação de entalpia (DH) é –19,5 kcal/mol e que a variação de entropia (DS) é 18 cal/grau . mol, podemos afirmar que a variação de energia livre (DG) do sistema é:
a) +19,25 kcal e espontâneo
b) –19,25 kcal e não espontâneo
c) +24,86 kcal e não espontâneo
d) –24,86 kcal e espontâneo
e) n.d.a.
04. (FEI) Determinar a espontaneidade da reação C2H2 + 2H2 ® C2H6 à temperatura de 100°C.
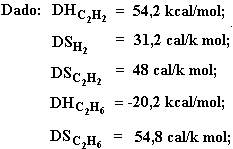 05. (FEI) Para uma dada reação sabe-se que DH = 20 kcal/mol e DS = 80 cal/mol . k. Qual o DG dessa reação a 1 000 K?
05. (FEI) Para uma dada reação sabe-se que DH = 20 kcal/mol e DS = 80 cal/mol . k. Qual o DG dessa reação a 1 000 K?
06. (BRASÍLIA) A energia de ligação média para a ligação C – H no metano CH4(g) é aproximadamente:
Dado: DHf0 (entalpia de formação-padrão)
CH4(g) = -17,9 kcal/mol
H(g) = +52,1 kcal/mol
C(g) = +170,9 kcal/mol
a) +99 kcal/mol
b) +60 kcal/mol
c) +73 kcal/mol
d) +397 kcal/mol
07. (PUC) Considerando a reação dada pela equação H2(g) + I2(g) e sabendo que as entropias-padrão, nas condições da reação são:
- para o H2(g): 31,2 cal/K . mol
- para o I2(g): 27,9 cal/K . mol
- para o HI(g): 49,3 cal/K . mol
Podemos concluir que a variação de entropia na reação dada, por mol de HI formado, em cal/K . mol, é igual a:
a) –4,9
b) –9,8
c) +19,7
d) +39,5
e) +108,4
08. (FEI) Por que motivo, às altas temperaturas, as reações químicas tendem a ser espontâneas?
09. (PUC – MG) Os DGf 0 da glicose e etanol em solução aquosa são –219,20 e –43,40 Kcal/mol, respectivamente, e o DGf 0 do dióxido de carbono gasoso é –94,30 Kcal/mol. A 25°C, o DG 0 em Kcal/mol da reação: Glicose ® 2 etanol + 2 CO2 é:
a) 494,60
b) –81,50
c) 81,50
d) –56,20
e) 56,20
DGf 0 = energia livre de formação
= energia livre padrão = energia livre normal
Resolução:
| 01. E | 02. Sim | 03. D |
04. DG = -53.700 cal e a reação é espontânea.
05. DG = -60 Kcal/mol
06. A
07. C
08. A espontaneidade de uma transformação está relacionada com a variação de entalpia e energia de organização (TDS) que dão valor da variação de energia livre (DG).
DG = DH – T DS À altas temperaturas a entropia (S) dos sistemas aumenta bastante, e, o valor de TD S adquire valor alto e positivo dando D G negativo. Devemos lembrar também que altas temperaturas aumentam a Energia Cinética das moléculas, favorecendo a espontaneidade.
09. D
FONTE:http://www.coladaweb.com/exercicios-resolvidos/exercicios-resolvidos-de- quimica/termoquimica
Exercícios sobre Concentração em mol/L ou molaridade

1-Uma solução de 368 g de glicerina (C3H8O3) em 1600 g de água apresenta densidade de 1,044 g/cm3. Calcule a concentração em mol/L dessa solução. Dados: massas atômicas: H = 1; C = 12;
O =16.
2-Qual massa de ácido sulfúrico (H2SO4) será necessária para preparar 2 litros de uma solução na concentração de 3 mol/L? Dado: M(H2SO4)= 98 g/mol.
3-(Fuvest-SP) A concentração de íons fluoreto em uma água de uso doméstico é de 5,0 · 10–5 mol/litro. Se uma pessoa tomar 3,0 litros dessa água por dia, ao fim de um dia, a massa de fluoreto, em miligramas, que essa pessoa ingeriu é igual a: (massa molar do fluoreto: 19,0 g/mol)
a) 0,9.
b) 1,3.
c) 2,8.
d) 5,7.
e) 15.
4-(Vunesp-SP) O limite máximo de concentração de íon Hg2+ admitido para seres humanos é de 6 miligramas por litro de sangue. O limite máximo, expresso em mol de Hg2+ por litro de sangue, é igual a: (massa molar de Hg = 200 g/mol)
a) 3 · 10–5.
b) 6 · 10–3.
c) 3 · 10–2.
d) 6.
e) 200.
Agora confira suas respostas:
- Resposta Questão 1A fórmula da concentração em mol/L ou molaridade (M) é:
M = __m1__
M1 . V(L)
Onde,
m1 = massa do soluto (da glicerina);
M1= massa molar do soluto;
V (L) = volume da solução em litros.
Para usar essa fórmula, precisamos descobrir primeiro V e M1. A massa molar da glicerina é calculada normalmente:
M1(C3H8O3)= (3 . 12) + (8 . 1) + (3 . 16) = 92 g/mol
Já o volume da solução é encontrado por meio da fórmula da densidade:
d = m / v → v = m / d
A massa da solução (m) é dada pela soma da massa do soluto (glicerina) com a do solvente (água):
m = 368 g + 1600 g = 1968 g
Assim, substituindo os dados na fórmula acima, para encontrar o valor do volume, temos:
V = 1968 g / 1,044g/cm³ = 1885 cm³
Na fórmula da concentração em mol/L, o volume tem que ser dado em L, por isso fazemos a seguinte transformação:
1 L = 1dm3
1cm³ = 0,001dm³
Se dm³ = L, então:
1 cm³ --------- 0,001 L
1885 cm³ ----- V (L)
V = 1,885 L
Finalmente, podemos substituir todos os valores na fórmula da concentração em mol/L e encontrá-la:
M = __m1__
M1 . V(L)
M = ________368 g______
(92 g/mol) . (1,885 L)
M = 2,1 mol/L - Resposta Questão 2- Dados do exercício:
m1 = ? (é o que se quer encontrar)
M1= 98 g/mol
V (L) = 2 L
M = 3 mol/L
Aplicando os dados na fórmula da concentração em mol/L, temos:
M = __m1__
M1 . V(L)
m1 = M . M1 . V(L)
m1 = 3 mol/L . 98 g/mol . 2 L
m1 = 588 g - Resposta Questão 3Alternativa “c”
- Dados do exercício:
m1 = ? (é o que se quer encontrar)
M1= 19,0 g/mol
V (L) = 3 L
M = 5 . 10-5 mol/L
Aplicando os dados na fórmula da concentração em mol/L, temos:
M = __m1__
M1 . V(L)
m1 = M . M1 . V(L)
m1 = 5 . 10-5 mol/L . 19,0 g/mol . 3 L
m1 = 285 . 10-5 g oum1 = 2,85 . 10-3 g, que é o mesmo que 2,85 mg. - Resposta Questão 4Alternativa “a”Dados:C (concentração comum) = 6 mg/LM1 = 200 g/molComo C é dado pela fórmula:C = m1
VEntão isso significa que:m1 =6 mg ou 6 . 10-3 gV = 1 LAssim, podemos aplicar na fórmula da concentração em mol/L para descobrir a resposta:M = __m1__
M1 . V(L)M = ___6. 10-3 g___
200 g/mol. 1 LM = 0,03 . 10-3 mol/L ou 3 . 10-5 mol/L
Exercícios sobre Concentração Comum
1-(Unicamp-SP) Evapora-se totalmente o solvente de 250 mL de uma solução aquosa de MgCl2 de concentração 8,0 g/L. Quantos gramas de soluto são obtidos?a) 8,0b) 6,0c) 4,0d) 2,0e) 1,02-Complete as lacunas da frase a seguir com os valores corretos:“Uma solução que apresenta concentração 80 g/L apresenta ... gramas de soluto, por litro da solução. Portanto, em 10 litros dessa solução devem existir ... gramas de soluto.”3-(UnB-DF) Em um rótulo de leite em pó integral, lê-se: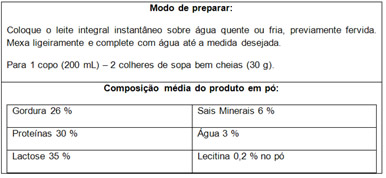 A porcentagem em massa indica-nos a quantidade de gramas de cada componente em 100 g de leite em pó. Calcule a concentração em massa (em g/L) de proteínas em um copo de 200 mL de leite preparado.4-(UFRN-RN)Uma das potencialidades econômicas do Rio Grande do Norte é a produção de sal marinho. O cloreto de sódio é obtido a partir da água do mar nas salinas construídas nas proximidades do litoral. De modo geral, a água do mar percorre diversos tanques de cristalização até uma concentração determinada. Suponha que, numa das etapas do processo, um técnico retirou 3 amostras de 500 mL de um tanque de cristalização, realizou a evaporação com cada amostra e anotou a massa de sal resultante na tabela a seguir:
A porcentagem em massa indica-nos a quantidade de gramas de cada componente em 100 g de leite em pó. Calcule a concentração em massa (em g/L) de proteínas em um copo de 200 mL de leite preparado.4-(UFRN-RN)Uma das potencialidades econômicas do Rio Grande do Norte é a produção de sal marinho. O cloreto de sódio é obtido a partir da água do mar nas salinas construídas nas proximidades do litoral. De modo geral, a água do mar percorre diversos tanques de cristalização até uma concentração determinada. Suponha que, numa das etapas do processo, um técnico retirou 3 amostras de 500 mL de um tanque de cristalização, realizou a evaporação com cada amostra e anotou a massa de sal resultante na tabela a seguir: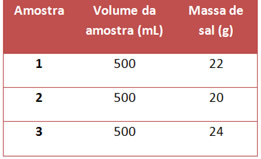 A concentração média das amostras será de:a) 48 g/L.b) 44 g/L.c) 42 g/L.d) 40 g/L5-Em uma solução aquosa de hidróxido de sódio (NaOH), calcule:a) A concentração em g/L de uma solução que contém 4,0 g de NaOH dissolvidos em 500 mL de solução.b) Para preparar 300 mL de uma solução dessa base com concentração de 5 g/L será preciso quanto de soluto?e) Qual será o volume em mL de uma solução aquosa de hidróxido de sódio que possui exatamente 1 mol dessa substância (NaOH = 40 g/mol), sendo que sua concentração é igual a 240 g/L?6-(Fuvest-SP) Considere duas latas do mesmo refrigerante, uma na versão “diet” e outra na versão comum. Ambas contêm o mesmo volume de líquido (300 mL) e têm a mesma massa quando vazias. A composição do refrigerante é a mesma em ambas, exceto por uma diferença: a versão comum contém certa quantidade de açúcar, enquanto a versão “diet” não contém açúcar (apenas massa desprezível de um adoçante artificial). Pesando-se duas latas fechadas do refrigerante, foram obtidos os seguintes resultados:
A concentração média das amostras será de:a) 48 g/L.b) 44 g/L.c) 42 g/L.d) 40 g/L5-Em uma solução aquosa de hidróxido de sódio (NaOH), calcule:a) A concentração em g/L de uma solução que contém 4,0 g de NaOH dissolvidos em 500 mL de solução.b) Para preparar 300 mL de uma solução dessa base com concentração de 5 g/L será preciso quanto de soluto?e) Qual será o volume em mL de uma solução aquosa de hidróxido de sódio que possui exatamente 1 mol dessa substância (NaOH = 40 g/mol), sendo que sua concentração é igual a 240 g/L?6-(Fuvest-SP) Considere duas latas do mesmo refrigerante, uma na versão “diet” e outra na versão comum. Ambas contêm o mesmo volume de líquido (300 mL) e têm a mesma massa quando vazias. A composição do refrigerante é a mesma em ambas, exceto por uma diferença: a versão comum contém certa quantidade de açúcar, enquanto a versão “diet” não contém açúcar (apenas massa desprezível de um adoçante artificial). Pesando-se duas latas fechadas do refrigerante, foram obtidos os seguintes resultados: Por esses dados, pode-se concluir que a concentração, em g/L, de açúcar no refrigerante comum é de, aproximadamente:a) 0,020b) 0,050c) 1,1d) 20e) 507-Uma solução foi preparada dissolvendo-se 4,0 g de cloreto de sódio (NaCl) em 2,0 litros de água. Considerando que o volume da solução permaneceu 2,0 L, qual é a concentração da solução final?a) 2g/Lb) 4g/Lc) 6 g/Ld) 8 g/Le) 10 g/L8-Um técnico de laboratório preparou uma solução aquosa de ácido sulfúrico (H2SO4) misturando 33 g desse ácido em 200 mL de água, com extremo cuidado, lentamente, sob agitação e em uma capela com exaustor. Ao final, a solução ficou com um volume de 220 mL. A concentração em g/L dessa solução é:a) 0,15b) 0,165c) 66d) 15e) 150
Por esses dados, pode-se concluir que a concentração, em g/L, de açúcar no refrigerante comum é de, aproximadamente:a) 0,020b) 0,050c) 1,1d) 20e) 507-Uma solução foi preparada dissolvendo-se 4,0 g de cloreto de sódio (NaCl) em 2,0 litros de água. Considerando que o volume da solução permaneceu 2,0 L, qual é a concentração da solução final?a) 2g/Lb) 4g/Lc) 6 g/Ld) 8 g/Le) 10 g/L8-Um técnico de laboratório preparou uma solução aquosa de ácido sulfúrico (H2SO4) misturando 33 g desse ácido em 200 mL de água, com extremo cuidado, lentamente, sob agitação e em uma capela com exaustor. Ao final, a solução ficou com um volume de 220 mL. A concentração em g/L dessa solução é:a) 0,15b) 0,165c) 66d) 15e) 150Respostas
- Resposta Questão 1Alternativa “d”
C = m1 V
8,0 g/L = __m1__ 0,25 L
m1 = 8,0 g/L . 0,25 L
m1 =2,0 g - Resposta Questão 280; 800
- Resposta Questão 345 g/L
- Primeiro calculamos a concentração da solução feita misturando-se 30 g do leite em pó integral em 200 mL (1 copo) de água. Lembre-se de transformar o volume para L (200 mL → 0,2L):
C = m1 → C = 30 g → C = 150,0 g/L
V 0,2 L
- Agora fazemos uma regra de três, visto que a proteína equivale a 30% da massa do leite:
100 % ---------- 150,0 g/L
30% ---------- x
X = 30 . 150 100
X = 45,0 g/L - Resposta Questão 4- Primeiramente, calculamos a concentração comum de cada amostra. Como a unidade pedida no exercício é g/L, o volume de 500 mL será passado para litros, dando um resultado de 0,5 L:
C = m1
V
Amostra 1: Amostra 2: Amostra 3:
C1 = 22 g C2 = 20 g C3 = 24 g
0,5 L 0,5 L 0,5 L
C1 = 44 g/L C2= 40 g/L C3 = 48 g/L
- Tirando a média:Cmédia = C1 + C2 + C3 →Cmédia = (44 + 40+ 48)g/L →Cmédia = 44 g/L
3 3 - Resposta Questão 5a)
1 L ---------- 1000 mL
X ------------500 mL
X = 500/1000
X = 0,5 L
C = m1 →C = 4,0 g →C = 8,0 g/L
V 0,5 L
b) 1 L ---------- 1000 mL
X ------------300 mL
X = 300/1000
X = 0,3 L
C = m1 →5 g/L = m1 → m1 = (5 g/L) . (0,3 L) → m1 = 1,5 g
V 0,3 L
c)
240 g--------------- 1000 mL (1 L)
40 g --------------- x
X = (40 g). (1000 mL)
240 g
X = 166, 7 mL - Resposta Questão 6Alternativa “e”
Sabendo que a diferença de massa entre o refrigerante comum e o diet é somente em razão do açúcar:
maçúcar = mrefrigerante comum – mrefrigerante diet
maçúcar = 331,2 – 316,2
maçúcar = 15 g
15 g de açúcar -------- 0,3 L de refrigerante (300 mL)
x ------------------------- 1 L de refrigerante
x = 1 . 15 / 0,3
x = 50 g de açúcar/L de refrigerante - Resposta Questão 7Alternativa “a”
C = m1 →C = 4,0 g →C = 2,0 g/L
V 2,0 L - Resposta Questão 8Alternativa “e”
Nesse caso, temos que passar o valor do volume da solução de mL para L:
1 L ---------- 1000 mL
X ------------220 mL
X = 220/1000
X = 0,22 L
Agora podemos fazer uma regra de três básica:
33 g de H2SO4 ------------ 0,22 L de solução
y ---------------------------- 1 L de solução
y = 1 L . 33 g
0,22 L
y = 150 g/L Exercícios sobre Densidade
 1-(FMU-SP) Um vidro contém 200 cm3 de mercúrio de densidade 13,6 g/cm3. A massa de mercúrio contido no vidro é:a) 0,8 kgb) 0,68 kgc) 2,72 kgd) 27,2 kge) 6,8 kg2-Três líquidos (água, benzeno e clorofórmio) foram colocados numa proveta, originando o seguinte aspecto:
1-(FMU-SP) Um vidro contém 200 cm3 de mercúrio de densidade 13,6 g/cm3. A massa de mercúrio contido no vidro é:a) 0,8 kgb) 0,68 kgc) 2,72 kgd) 27,2 kge) 6,8 kg2-Três líquidos (água, benzeno e clorofórmio) foram colocados numa proveta, originando o seguinte aspecto: A seguir temos uma tabela com as densidades de cada líquido. Baseando-se nessas informações e em seus conhecimentos sobre densidade, relacione as substâncias A, B e C com as mencionadas na tabela. Justifique sua resposta.
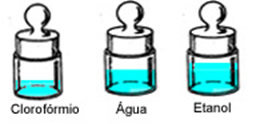
A seguir temos uma tabela com as densidades de cada líquido. Baseando-se nessas informações e em seus conhecimentos sobre densidade, relacione as substâncias A, B e C com as mencionadas na tabela. Justifique sua resposta. 3-Uma solução foi preparada misturando-se 30 gramas de um sal em 300 g de água. Considerando-se que o volume da solução é igual a 300 mL, a densidade dessa solução em g/mL será de:a) 10,0b) 1,0c) 0,9d) 1,1e) 0,14-(Unicamp-SP) Três frascos de vidro transparentes, fechados, de formas e dimensões iguais, contêm cada um a mesma massa de líquidos diferentes. Um contém água, o outro, clorofórmio e o terceiro, etanol. Os três líquidos são incolores e não preenchem totalmente os frascos, os quais não têm nenhuma identificação. Sem abrir os frascos, como você faria para identificar as substâncias?A densidade (d) de cada um dos líquidos, à temperatura ambiente, é:d(água) = 1,0 g/cm3d(clorofórmio) = 1,4 g/cm3d(etanol) = 0,8 g/cm35-Na tabela abaixo temos as densidades de alguns materiais sólidos. Se eles forem adicionados à água líquida e pura, à temperatura ambiente, qual deles flutuará?Pau-brasil .............................. 0,4 g/cm3Alumínio ................................ 2,70 g/cm3Diamante .................................3,5 g/cm3Chumbo...................................11,3 g/cm3Carvão ..................................... 0,5 g/cm3Mercúrio .................................13,6 g/cm3Água ......................................... 1,0 g/cm36-Uma solução aquosa foi preparada dissolvendo-se certa massa de hidróxido de sódio (NaOH) em 600 mL de água, originando um volume de 620 mL. Qual será a massa do soluto presente nessa solução? (Dados: densidade da solução = 1,19 g/mL; densidade da água = 1,0 g/mL)a) 222,4 gb) 137,8 gc) 184,5 gd) 172,9 ge) 143,1 g7-(Fuvest-SP) Em uma indústria, um operário misturou, inadvertidamente, polietileno (PE), policloreto de vinila (PVC) e poliestireno (PS), limpos e moídos. Para recuperar cada um destes polímeros, utilizou o seguinte método de separação: jogou a mistura em um tanque contendo água (densidade = 1,00 g/cm3), separando, então, a fração que flutuou (fração A) daquela que foi ao fundo (fração B). Depois, recolheu a fração B, secou-a e jogou-a em outro tanque contendo solução salina (densidade = 1,10g/cm3), separando o material que flutuou (fração C) daquele que afundou (fração D).(Dados: densidade na temperatura de trabalho em g/cm3: polietileno = 0,91 a 0,98; poliestireno = 1,04 a 1,06; policloreto de vinila = 1,5 a 1,42)As frações A, C e D eram, respectivamente:a) PE, PS e PVCb) PS, PE e PVCc) PVC, PS e PEd) PS, PVC e PEe) PE, PVC e PS8-(UFPE) Para identificar três líquidos – de densidades 0,8,1,0 e 1,2 – o analista dispõe de uma pequena bola de densidade 1,0. Conforme as posições das bolas apresentadas no desenho a seguir, podemos afirmar que:
3-Uma solução foi preparada misturando-se 30 gramas de um sal em 300 g de água. Considerando-se que o volume da solução é igual a 300 mL, a densidade dessa solução em g/mL será de:a) 10,0b) 1,0c) 0,9d) 1,1e) 0,14-(Unicamp-SP) Três frascos de vidro transparentes, fechados, de formas e dimensões iguais, contêm cada um a mesma massa de líquidos diferentes. Um contém água, o outro, clorofórmio e o terceiro, etanol. Os três líquidos são incolores e não preenchem totalmente os frascos, os quais não têm nenhuma identificação. Sem abrir os frascos, como você faria para identificar as substâncias?A densidade (d) de cada um dos líquidos, à temperatura ambiente, é:d(água) = 1,0 g/cm3d(clorofórmio) = 1,4 g/cm3d(etanol) = 0,8 g/cm35-Na tabela abaixo temos as densidades de alguns materiais sólidos. Se eles forem adicionados à água líquida e pura, à temperatura ambiente, qual deles flutuará?Pau-brasil .............................. 0,4 g/cm3Alumínio ................................ 2,70 g/cm3Diamante .................................3,5 g/cm3Chumbo...................................11,3 g/cm3Carvão ..................................... 0,5 g/cm3Mercúrio .................................13,6 g/cm3Água ......................................... 1,0 g/cm36-Uma solução aquosa foi preparada dissolvendo-se certa massa de hidróxido de sódio (NaOH) em 600 mL de água, originando um volume de 620 mL. Qual será a massa do soluto presente nessa solução? (Dados: densidade da solução = 1,19 g/mL; densidade da água = 1,0 g/mL)a) 222,4 gb) 137,8 gc) 184,5 gd) 172,9 ge) 143,1 g7-(Fuvest-SP) Em uma indústria, um operário misturou, inadvertidamente, polietileno (PE), policloreto de vinila (PVC) e poliestireno (PS), limpos e moídos. Para recuperar cada um destes polímeros, utilizou o seguinte método de separação: jogou a mistura em um tanque contendo água (densidade = 1,00 g/cm3), separando, então, a fração que flutuou (fração A) daquela que foi ao fundo (fração B). Depois, recolheu a fração B, secou-a e jogou-a em outro tanque contendo solução salina (densidade = 1,10g/cm3), separando o material que flutuou (fração C) daquele que afundou (fração D).(Dados: densidade na temperatura de trabalho em g/cm3: polietileno = 0,91 a 0,98; poliestireno = 1,04 a 1,06; policloreto de vinila = 1,5 a 1,42)As frações A, C e D eram, respectivamente:a) PE, PS e PVCb) PS, PE e PVCc) PVC, PS e PEd) PS, PVC e PEe) PE, PVC e PS8-(UFPE) Para identificar três líquidos – de densidades 0,8,1,0 e 1,2 – o analista dispõe de uma pequena bola de densidade 1,0. Conforme as posições das bolas apresentadas no desenho a seguir, podemos afirmar que: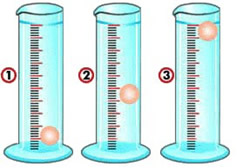 a) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 0,8, 1,0 e 1,2.b) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,2, 0,8 e 1,0.c) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,0, 0,8 e 1,2.d) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,2, 1,0 e 0,8.e) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,0, 1,2 e 0,8.(UFPE) Para identificar três líquidos – de densidades 0,8,1,0 e 1,2 – o analista dispõe de uma pequena bola de densidade 1,0. Conforme as posições das bolas apresentadas no desenho a seguir, podemos afirmar que:
a) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 0,8, 1,0 e 1,2.b) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,2, 0,8 e 1,0.c) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,0, 0,8 e 1,2.d) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,2, 1,0 e 0,8.e) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,0, 1,2 e 0,8.(UFPE) Para identificar três líquidos – de densidades 0,8,1,0 e 1,2 – o analista dispõe de uma pequena bola de densidade 1,0. Conforme as posições das bolas apresentadas no desenho a seguir, podemos afirmar que: a) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 0,8, 1,0 e 1,2.b) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,2, 0,8 e 1,0.c) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,0, 0,8 e 1,2.d) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,2, 1,0 e 0,8.e) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,0, 1,2 e 0,8.
a) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 0,8, 1,0 e 1,2.b) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,2, 0,8 e 1,0.c) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,0, 0,8 e 1,2.d) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,2, 1,0 e 0,8.e) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,0, 1,2 e 0,8.Respostas
- Resposta Questão 1Alternativa “c”
Pela densidade sabemos que há 13,6 g de mercúrio em 1 cm3. Assim, podemos resolver esse problema com uma regra de três simples:
13,6 g de mercúrio ------------------ 1 cm3
x ----------------------------- 200 cm3
X = 200 . 13,6 →x = 2720 g ou 2,720 kg
1 - Resposta Questão 2A = benzeno;
B = água;
C = clorofórmio.Isso se dá porque os líquidos menos densos ficam sobre os mais densos. Assim, como o benzeno é o menos denso, ele fica na superfície; e como o clorofórmio é o mais denso, ele afunda, ficando na parte inferior, deixando a água no meio. - Resposta Questão 3A alternativa correta é a letra “d”
Dados:
m1 (massa do soluto) = 30 g
m2 (massa do solvente) = 300 g
m (massa da solução) = (30 + 300)g = 330 g
v (volume da solução) = 300 mL
- Substituindo os valores na fórmula da densidade:
d = m
v
d = 330 g 300 mL
d = 1,1 g/mL - Resposta Questão 4A partir da expressão que permite calcular densidades (d = m/v), temos m = d . v.
mágua = dágua . vágua
mclorofórmio = dclorofórmio . vclorofórmio
metanol = detanol . vetanol
No enunciado foi dito que a massa é a mesma. Portanto, o líquido de maior densidade deverá apresentar o menor volume. Como o clorofórmio é o que possui a densidade maior (1,4 g/cm3) então ele seria o que teria o menor volume. Já o volume do etanol seria o maior, e o da água seria intermediário. A ilustração a seguir nos fornece uma representação dos três frascos:
- Resposta Questão 5Flutuarão os materiais que possuírem a densidade menor que 1,0 g/cm3, que é a densidade da água. Portanto: o pau-brasil e o carvão.
- Resposta Questão 6
A alternativa correta é a letra “b”.
Dados:
- m1 (massa do soluto NaOH) = ?
- m2 (massa do solvente ─ água) = ?
- v (volume da solução) = 620 mL
- v2 (volume do solvente – água) = 600 mL
- d (densidade da solução) = 1,19 g/mL
- d2 (densidade da água) = 1,0 g/mL
d = m1 + m2 v
- Para substituir os valores nessa fórmula e resolver a questão é preciso descobrir primeiro o valor de m2:
d2 = m2 →m2 = d2 . v2 →m2 = (1,0 g/mL) . (600 mL) →m2 = 600 g
v2
- Agora sim temos todos os dados para substituir na fórmula da densidade da solução e descobrir o valor da massa do soluto:d = m1 + m2 v
1,19 g/mL = m1 + 600g 620 mL
(1, 19 g/mL) . (620 mL) = m1 + 600g
737, 8 g = m1 + 600 g
m1 = (737, 8 – 600) g
m1 = 137,8 g - Resposta Questão 7Alternativa “a”
A fração A, que flutuou na água (d = 1,00 g/cm3), foi o polietileno (densidade entre 0,91 e 0,98). A fração C, que flutuou na solução salina (d = 1,10 g/cm3), foi o poliestireno (densidade entre 1,04 e 1,06). A fração D, portanto, é o policloreto de vinila, cuja densidade é maior que a da solução salina, ou seja, entre 1,5 g/cm3 e 1,42 g/cm3. - Resposta Questão 8A alternativa correta é a letra “a”.
Na proveta 1, a bolinha é mais densa que o líquido, pois se encontra no fundo do recipiente. Logo, o líquido é menos denso que a bolinha (d = 0,8). Na proveta 2, a bolinha não afunda nem flutua, isso significa que possui a mesma densidade que o líquido (d = 1,0). Na proveta 3, a bolinha flutua na superfície do líquido, logo, o líquido possui densidade maior do que a da bolinha (d = 1,2). Exercícios sobre Título ou Porcentagem em Massa
1-(ENCE-UERJ-Cefet-UFRJ) Para a prevenção de cáries, em substituição à aplicação local de flúor nos dentes, recomenda-se o consumo de "água fluoretada". Sabendo que a porcentagem, em massa, de fluoreto de sódio na água é de 2 · 10–4%, um indivíduo que bebe 1 litro dessa água, diariamente, terá ingerido uma massa desse sal igual a: (densidade da água fluoretada: 1,0 g/mL)a) 2 · 10–3 g.b) 3 · 10–3 g.c) 4 · 10–3 g.d) 5 · 10–3 g.e) 6 · 10–3 g.2-Qual a massa de água existente em 600 g de uma solução aquosa de brometo de potássio (KBrO3(aq)) com τ = 0,25?3-Calcule o título e a porcentagem em massa de uma solução feita a partir da dissolução de 368 g de glicerina, C3H8O3, em 1600 g de água.Respostas
- Resposta Questão 1Alternativa “a”
O valor da porcentagem em massa indica que existem:
2 · 10–4 g de NaF em 100 g de solução
Como a densidade da solução é 1,0 g/mL, ou seja, 1 000 g/L, se um indivíduo ingerir 1 L dessa
solução, ele estará ingerindo 1 000 gramas da solução. Então:
100 g de solução ------------ 2 · 10–4 g de NaF
1 000 g de solução ---------- x
x = 1 000 g de solução · 2 · 10–4 g de NaF ⇒ x = 2 · 10–3 g de NaF
100 g de solução
Outra maneira de resolvermos essa questão é pela aplicação da fórmula de título (τ):
τ · 100% = % em massa em que: m1 = ?
m1· 100% = % em massa m = 1 000 g
m % em massa = 2 · 10–4 %
_m1 __ .100% = 2 · 10–4%
1 000 g
m1 = 2 · 10–4% · 1 000 g⇒m1 = 2 · 10–3 g de NaF 100% - Resposta Questão 2Se τ = 0,25, então significa que temos 25 g de soluto em 100 g de solução.
25 g de KBrO3(aq)-------- 100 g de solução
x ---------------------------600 g de solução
x = 600 . 25
100
x = 150 g de soluto (KBrO3(aq))
mágua = msolução – msolutomágua = (600 – 150)g
mágua = 450 g - Resposta Questão 3τ = m1
m
τ =___m1______ (m1 + m2)
τ = __368 g_____
(368 + 1600)g
τ = 0,187
Porcentagem em massa do soluto:
τ%= τ. 100%
τ%= 0,187. 100%
τ%= 18,7%
Porcentagem em massa do solvente:
100% - 18,7% = 81,3%

Nenhum comentário:
Postar um comentário