Hoje iremos ensinar sobre Equações Termoquímicas, apesar do nome o assunto não é tão difícil. Vamos vê?
Uma equação termoquímica, também chamada de fórmula termoquímica, é uma forma de se representar uma reação química, semelhante a uma equação química comum, que informa a variação de entalpia resultante do processo, a pressão e a temperatura ambiente, podendo informar também os estados físicos dos reagentes e produtos.
Quando não são informadas a pressão e a temperatura, considera-se as
condições ambiente (também chamada de estado ou condição padrão de uma
substância), onde pressão = 1 atm e temperatura = 25ºC, ou 298K. Exemplo de reação termoquímica:
O sinal da entalpia determina a quantidade de energia absorvida ou liberada pela reação. Uma entalpia positiva mostra uma reação endotérmica, que absorve energia. Uma entalpia negativa mostra uma reação exotérmica, que liberta energia.
A notação padrão de fórmulas termoquímicas é a seguinte:
Há também uma notação alternativa:
- Para as reações endotérmicas:

- Para as reações exotérmicas:

Da mesma forma que se faz em reações químicas comuns, é possível
somar reações termoquímicas para eliminar coeficientes. Quando é
necessário inverter uma reação, é necessário também inverter o sinal da
variação de entalpia.
Exemplo:

- Somando essas equações, obtém-se uma terceira:

Observações:
1. Estado padrão na termoquímica é caracterizado por:
– Temperatura de 25°C
– Pressão de 1atm.
– Estrutura cristalina ou alotrópica mais estável (se for o caso).
– Estado físico usual da substância.
2. Por convenção, substância simples ou elemento químico no estado padrão possui entalpia sempre zero.
– Calor ou entalpia padrão de formação (DH)0f : endotérmico ou exotérmico.
– Calor ou entalpia de combustão (exotérmico).
– Calor ou entalpia ou energia de ligação (endotérmico).
– Calor ou entalpia de neutralização (exotérmico).
– Lei de Hess.
Calor ou entalpia padrão de formação
É a variação de entalpia, ou seja, quantidade de calor liberada ou
absorvida por um processo na formação de 1mol de determinada substância
partindo-se de suas respectivas substâncias simples, admitindo-se todos
os participantes no estado padrão.
O calor de formação: permitiu calcular a entalpia de várias substâncias até então desconhecidas, a partir da variação de entalpia (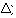 H)0f da própria reação.
H)0f da própria reação.
Exemplo: 1C(gr) + 1O2 (g) 1CO2 (g)
1CO2 (g)
(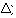 H)0f = – 94kcal/mol
H)0f = – 94kcal/mol
(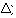 H)0f = Hp – Hr
H)0f = Hp – Hr
(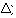 H)0f = ( HCO2 (g)) – ( HC(g) + HO2(g) )
H)0f = ( HCO2 (g)) – ( HC(g) + HO2(g) )
(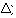 H)0f = HCO2 (g) = – 94kcal/mol
H)0f = HCO2 (g) = – 94kcal/mol
Para melhor entendimento assistar o vídeo:
Fonte: pt.wikipedia.org/wiki/Equação_termoquímica
www.colegioweb.com.br › Colégio › Química › Termoquímica II
www.colegioweb.com.br › Colégio › Química › Termoquímica II




Muito bom para um segundo melhor blog de química da sala... :P
ResponderExcluirhahaha!