A Termoquímica nada mais é do que a parte da química que estuda essas oscilações de energia dos materiais e suas reações, analisando se houve perda ou ganho de energia.
Levando-se em conta essa variação de calor, podemos dividir os processos ou reações químicas em endotérmicas e exotérmicas.
- Reações Endotérmicas:
A reação ocorre com ABSORÇÃO DE CALOR (endo = para dentro).
A fotossíntese realizada pelas plantas é um exemplo de reação endotérmica,
pois só se realiza por meio de um fornecimento contínuo de energia.
Outro exemplo é a fusão do gelo, que só é possível por meio da absorção
de calor, que rompe as ligações de hidrogênio entre as moléculas de
água, mudando-a do estado sólido para o líquido.
Reparem
que nas reações endotérmicas o calor é representado na equação do lado
dos reagentes, para mostrar que nesta transformação houve absorção de
energia.
Podemos representar as reações endotérmicas através do seguinte gráfico:
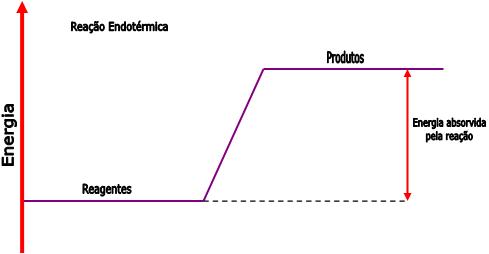
Podemos representar as reações endotérmicas através do seguinte gráfico:

- Reações Exotérmicas:
A reação ocorre com LIBERAÇÃO DE CALOR (exo = para fora).
Tomando
a água de novo como exemplo, temos na sua transformação do estado
gasoso para o líquido uma reação exotérmica. É o que acontece na sauna. O
vapor d’água transforma-se em água líquida, por meio da formação de
ligações de hidrogênio, liberando calor.
Outro
exemplo típico deste tipo de reação são as reações de combustão. O
carvão, por exemplo, quando queimado, libera calor. Todas as reações de
combustão são exotérmicas.
Nas reações exotérmicas, como vocês puderam notar, o calor está
representado na equação do lado dos produtos, o que significa que a
transformação ocorreu com liberação de energia.
Graficamente as reações podem ser assim representadas:
Nestes gráficos podemos verificar que nas reações endotérmicas a energia final (dos produtos) é maior
que a energia inicial (dos reagentes). Devido a isso, convencionou-se
representar a variação de calor com o sinal positivo (+). Por outro
lado, nas reações exotérmicas a energia final é menor que a energia inicial, sendo, por isso, representada por um sinal negativo (-).
A energia absorvida ou liberada em uma dada transformação pode ser medida?
É precisamente essa a função da termoquímica!
Essa medição é feita com a ajuda de um aparelho chamado calorímetro.
Este aparelho é basicamente constituído de um recipiente com paredes
adiabáticas, ou seja, que não troca calor com o ambiente, contendo uma
massa conhecida de parede água, na qual é introduzido um determinado
sistema em reação. O recipiente contém um agitador e um termômetro que
mede a variação de temperatura durante a reação. Sendo assim, podemos
determinar a variação de calor de uma reação química por meio da
expressão:
Q = m . c . Δt
|
Na qual:
Q = quantidade de calor liberado ou absorvido pela reação (caloria ou joule);
m = massa de água (gramas) presente no calorímetro;
c = calor específico do líquido presente no calorímetro (para a água é 1cal/g . ºC);
Δt = variação de temperatura sofrida pela massa de água devido à ocorrência da reação (graus Celsius).
Este
calor de reação pode ser medido em um calorímetro hermeticamente
fechado, à volume constante, sendo sua variação de energia chamada variação de energia interna, ou em um calorímetro aberto, à pressão constante, sendo sua variação de energia chamada de variação de entalpia.
Como
a grande maioria das reações químicas ocorre em recipientes abertos, à
pressão constante, veremos com mais detalhe a variação de entalpia das
reações. Mas esse assunto vai ficar para o próximo tópico, acompanhe!
Bibliografia:
http://www.colegioweb.com.br/quimica/reacoes-exotermicas-e-endotermicas.html
http://www.qieducacao.com/2010/11/termoquimica-i-reacoes-endotermicas-e.html
Bibliografia:
http://www.colegioweb.com.br/quimica/reacoes-exotermicas-e-endotermicas.html
http://www.qieducacao.com/2010/11/termoquimica-i-reacoes-endotermicas-e.html





muito bom! esta postagem está de parabéns, agora vou tirar um notão prova de sexta! Valeu!
ResponderExcluirTop d+... Ajucou o colega ai (Felipe_santos) em 2012 e me ajudou muito tbm em 2015!!!! SIMPLSMENTE FANTASTICO ESSE TOPCO!!!!
ResponderExcluir